Toxicité aiguë
Les données disponibles chez l’animal montrent que le BBP présente une toxicité aiguë faible par voies orale et cutanée. Il n’est ni irritant ni sensibilisant pour la peau mais il est légèrement irritant pour les yeux.
La toxicité aiguë par voies orale et cutanée est très faible.
Par voie orale, une DL50 de 20 400 mg/kg a été déterminée chez le rat, après administration par gavage de 12 600 - 15 300 - 20 000 ou 25 100 mg/kg de BBP pur [21]. Les animaux exposés présentent une perte d’appétit, une diminution de l’activité, une faiblesse marquée et un collapsus ; le décès survient un ou deux jours après l’exposition. Les examens histologiques révèlent des zones hémorragiques au niveau des poumons, une décoloration du foie et une inflammation aiguë du tractus gastro-intestinal. Le NTP rapporte des DL50 de 2330 mg/kg chez les rats mâles et femelles, de 6160 mg/kg chez la souris mâle et de 4170 mg/kg chez les souris femelle, 14 jours après une exposition par gavage à du BBP dilué dans de l’huile de maïs [22].
Par voie cutanée, une DL50 supérieure à 10 000 mg/kg de BBP a été déterminée après application de 3980-6310 ou 10 000 mg/kg sur la peau de lapins, pendant 24 heures (substance pure). Deux à quatre jours après l’application, une perte d’appétit et une baisse de l’activité sont observées ; aucune mortalité n’est survenue [21]. Chez le rat, une DL50 cutanée de 6700 mg/kg est mentionnée, avec la présence de réactions locales (hyperhémie, érosion et desquamation), mais sans aucun détail supplémentaire [3].
Aucune donnée n’est disponible par inhalation.
Irritation, sensibilisation [21]
L’application pendant 24 heures de 0,5 mL de BBP pur (test de Draize), sur la peau intacte ou abîmée de 6 lapins n’entraîne aucune irritation. Le potentiel irritant du BBP a aussi été testé au niveau des oreilles de souris : 24 ou 48 heures après l’application de 30 µl de BBP, l’épaisseur de l’oreille est inchangée.
Au niveau oculaire, l’instillation de 0,1 mL de BBP pur dans le sac conjonctival de lapins est à l’origine d’une légère irritation, persistant à 48 heures.
Plusieurs tests réalisés pour évaluer le potentiel sensibilisant cutané du BBP, dont un test de maximisation (GPMT), donnent des résultats négatifs [14].
Toxicité subchronique, chronique
A la suite d’une administration répétée de BBP, des effets hépatiques, rénaux, pancréatiques et hématologiques sont observées. Au niveau hépatique, une hépatomégalie est rapportée, en lien avec une prolifération de peroxysomes. Ceci est également observé avec d’autres phtalates.
A la suite de l’administration quotidienne à des rats de BBP, pendant 14 jours (0 – 312 – 624 – 1250 ou 2500 mg/kg pc/j, dans la nourriture), les animaux exposés aux 2 plus fortes doses présentent une perte de poids et apparaissent affaiblis et léthargiques ; aucune mortalité n’est observée. Une augmentation dose-dépendante du poids du foie et des reins est constatée à partir de 312 mg/kg pc/j, de même qu’une diminution du nombre de cellules dans la moelle osseuse à partir de 1250 mg/kg pc/j et une hépatite chronique et une diminution du nombre de lymphocytes dans le thymus à la plus forte dose [23].
L’administration de BBP pendant 90 jours (rats Wistar, 0 – 151 – 381 ou 960 mg/kg pc/j dans la nourriture) est à l’origine d’effets rénaux, hépatiques et pancréatiques à partir de 381 mg/kg pc/j, principalement chez les mâles. Une augmentation du poids des reins et une diminution du volume urinaire sont rapportées ; des tâches rouges apparaissent sur le foie des rats et au niveau pancréatique, des changements histologiques se traduisent, entre autres, par un grossissement des îlots de Langerhans et une vacuolisation cellulaire. A la plus forte dose, le poids du foie est augmenté, avec présence de foyers nécrotiques chez les mâles, et une légère anémie est observée. Des rats Sprague-Dawley ont été exposés de manière simultanée et apparaissent moins sensibles à la toxicité du BBP que les rats Wistar (augmentation du poids du foie et des reins seulement à partir de 750 mg/kg pc/j). A partir de ces résultats, une NOAEL de 151 mg/kg pc/j peut être déterminée [21].
Au cours d’une étude menée sur 26 semaines, des rats ont été exposés à 0 – 30 – 60 – 180 – 550 ou 1660 mg/kg pc/j de BBP dans la nourriture. Le nombre d’érythrocytes diminue dès 180 mg/kg pc/j ; à partir de 550 mg/kg pc/j, le taux d’hémoglobine augmente ; à la plus forte dose, les animaux présentent une anémie macrocytaire avec baisse de l’hématocrite et hausse du nombre de réticulocytes [22].
Le BBP entraîne une prolifération des peroxysomes moindre que celle du DEHP, caractérisée par une hypertrophie hépatique et une augmentation de l’activité de la palmitoyl-CoA [24].
Par inhalation, très peu d’informations sont disponibles. A la suite d’une exposition pendant 4 semaines à 0 – 49 – 144 – 526 ou 0 – 360 – 1000 – 2100 mg/m3 (exposition corps entier, 6 h/j, 5 j/sem, 90 % des gouttelettes de l’aérosol inférieures à 10 µm), une diminution du poids corporel est notée chez les rats exposés aux plus fortes concentrations (526 et 2100 mg/m3). Chez les animaux exposés à 2100 mg/m3, une atrophie des testicules et de la rate est aussi observée. Aucun effet sur les paramètres hématologiques, biochimiques ou urinaires n’est rapporté. Au cours d’une étude menée sur 13 semaines, dans les mêmes conditions expérimentales (0 – 51 – 218 – 789 mg/m3), les rats exposés à 789 mg/m3 présentent une augmentation significative du poids du foie et des reins et une diminution de la glycémie (mâles uniquement). A partir de cette étude, une NOAEC de 218 mg/m3 peut être établie [21].
Aucune information n’est disponible concernant la toxicité chronique du BBP par voie cutanée.
Effets génotoxiques [3, 14, 22]
D’après les données disponibles, le BBP ne présente pas de potentiel génotoxique.
Des résultats négatifs ont été obtenus lors de la réalisation des tests de mutagenèse et de clastogenèse suivants :
- in vitro, essais de mutations géniques sur Salmonella typhimurium (test d’Ames) et sur cellules de lymphome de souris ; essais d’échanges de chromatides sœurs ou d’aberrations chromosomiques sur cellules ovariennes de hamster chinois, avec ou sans activation métabolique ;
- in vivo, tests des micronoyaux réalisés chez des rates gestantes (exposées via l’eau de boisson à 0,18 mg/kg/j, pendant la gestation et la lactation) ; essai de mutation létale récessive liée au sexe chez la drosophile (cellules germinales mâles, jusqu’à 50 000 ppm dans la nourriture ou injection de 500 ppm) ; essai de mutation létale dominante chez la souris.
Après l’injection intra-péritonéale de 1250 – 2500 ou 5000 mg/kg de BBP, en solution dans de l’huile de maïs à des souris mâles, une légère augmentation des échanges de chromatides sœurs est observée dans les cellules de moelle osseuse (17 heures et 42 heures après injection) ; concernant les aberrations chromosomiques, une tendance positive est présente 17 heures après l’injection, qui n’est pas retrouvée après 36 heures.
Des essais de transformations cellulaires donnent des résultats positifs sur les cellules embryonnaires de hamster, après une exposition de 7 jours (2 – 5 – 10 µg/mL de BBP) mais pas sur les cellules de souris.
Effets cancérogènes [14, 22, 25, 26]
L’exposition prolongée au BBP semble à l’origine de tumeurs pancréatiques mais seulement chez les rats mâles. En l’état actuel des connaissances, il est difficile de conclure quant au potentiel cancérogène du BBP.
Les potentiels effets cancérogènes du BBP ont été évalués chez le rat et la souris mais aucun effet cancérogène n’est rapporté chez la souris.
Les rats ont été exposés pendant 2 ans à 120 – 240 – 500 mg/kg pc/j (mâles) ou à 300 – 600 – 1200 mg/kg pc/j (femelles), dans la nourriture [22]. Chez les mâles, seule une augmentation des hyperplasies et des adénomes / carcinomes du pancréas est observée, chez les animaux exposés à la plus forte dose. Chez les femelles exposées à 1200 mg/kg pc/j, 2 sur 50 développent des adénomes pancréatiques, très rarement observés dans les contrôles historiques et donc probablement liés au traitement ; une augmentation de l’incidence des hyperplasies et des papillomes de la vessie est aussi rapportée.
En parallèle, une étude a été réalisée en diminuant la dose journalière de nourriture donnée aux animaux afin de tester l’influence de la prise de poids sur la survenue de cancers [25]. Ainsi, des rats ont été exposés à 0 – 500 mg/kg pc/j (mâles) ou 1200 mg/kg pc/j (femelles), pendant 2 ans ou durant toute leur vie, la quantité de nourriture offerte étant limitée de manière à réduire de 15 % la prise de poids des animaux. Chez les mâles, aucun néoplasme n’est observé que cela soit après une exposition de 2 ans ou vie entière. Chez les femelles, des papillomes et des carcinomes de la vessie sont rapportés après une exposition vie entière ; leur absence dans l’étude menée sur 2 ans suggère que la durée de l’étude, et non le poids des animaux, soit un facteur déclenchant l’apparition de ces tumeurs.
Dans une étude plus ancienne, déjà menée par le NTP, des rats ont été exposés à 360 et 720 mg/kg pc/j de BBP dans la nourriture pendant 2 ans [26]. La mort prématurée de 30 % des rats mâles, exposés à la plus forte dose, a conduit les auteurs à sacrifier l’ensemble des rats mâles après 30 semaines d’exposition. Chez les rates exposées à la plus forte dose, l’incidence des leucémies à cellules mononucléées est significativement augmentée, tout en restant dans les limites des contrôles historiques. Cet effet n’a pas été retrouvé dans l’étude menée en 1997 avec des doses supérieures. Par ailleurs, l’augmentation de l’incidence des leucémies de ce type est sans équivalent chez l’homme et n’est pas prise en considération dans les évaluations de la cancérogénicité humaine. Chez les souris, aucun potentiel cancérogène n’a été mis en évidence lors de cette étude.
Effets sur la reproduction
Les testicules sont un organe cible du BBP et des atteintes sévères du système reproducteur mâle ont clairement été mises en évidence chez les rongeurs par voie orale, avec pour conséquence une altération de la fertilité. Par ailleurs, le BBP induit une embryolétalité importante, des malformations et des retards de croissance dans la descendance.
Fertilité
Plusieurs études rapportent une diminution du poids moyen des organes reproducteurs mâles (testicules, épididymes, prostate, vésicules séminales). Au cours des études subchroniques, ces effets apparaissent chez les rats exposés à 1000 mg/kg pc/j pendant 29 jours (gavage) ou à 1250 mg/kg pc/j pendant 14 jours (via la nourriture) [23, 27]. Les études sur 2 générations retrouvent cette diminution de poids des organes reproducteurs chez les mâles F1, pour des doses plus faibles comprises entre 400 et 750 mg/kg pc/j [28 à 30]. La diminution du poids des ovaires n’est observée que dans une seule étude, chez les femelles F1 exposées à 500 mg/kg pc/j [30].
Les modifications pondérales des organes reproducteurs sont généralement associées à des lésions histopathologiques : atrophie des tubes séminifères, hyperplasie des cellules de Leydig, perte de l’épithélium germinal ou dégénérescence des testicules [23, 27 à 30]. Dans les études 2 générations, ces effets sont observés chez les mâles F1 [28 à 30].
La spermatogénèse est atteinte, avec une diminution du nombre de spermatozoïdes et de leur motilité, dès 200 mg/kg pc/j (10 semaines, dans la nourriture) [22, 27, 28, 31]. Une diminution du nombre de spermatocytes et de spermatogonies dans les tubes séminifères est par ailleurs observée dans une étude 2 générations, chez les mâles F1 à partir de 500 mg/kg pc/j [31]. La quantité de testostérone produite est réduite après 14 jours d’exposition à 1250 mg/kg pc/j de BBP [23].
Au cours des études réalisées sur 2 générations, le BBP est à l’origine d’une diminution des indices de fertilité chez les mâles de la génération F1 [28, 29]. Le délai avant l’accouplement est allongé et les nombres d’implantations et de gestations diminuent [22, 27].
Les principaux effets sont résumés dans le tableau suivant, avec les doses les plus faibles (LOAEL) pour lesquelles ils ont été observés.
| Effets | LOAEL | Conditions expérimentales | Réf. biblio |
| Diminution du poids des organes reproducteurs mâles | 400 mg/kg pc/j - F1 | Etude 2 générations, rats Gavage, 0 – 100 – 200 ou 400 mg/kg/j | [29] |
| Modifications histologiques des organes reproducteurs mâles | 400 mg/kg pc/j - F1 |
| Effets sur les indices de fertilité / conception / implantations | 400 mg/kg pc/j - F1 |
| Effets sur les spermatozoïdes | 200 mg/kg pc/j | Etude subchronique, 10 semaines, rats mâles Nourriture, 0 - 20 – 200 – 2200 mg/kg/j | [30] |
| Diminution du poids des ovaires | 500 mg/kg pc/j - F1 | Etude 2 générations, rats Gavage, 0 – 20 – 100 – 500 mg/kg/j | [22] |
Développement
Dans des études du NTP, des rats et des souris ont été exposés respectivement à 0 – 420 – 1100 – 1640 mg/kg pc/j et 0 – 182 – 910 – 2330 – 4121 mg/kg pc/, dans la nourriture, du 6ème au 15ème jour de gestation [32, 33]. Pour les 2 espèces, aucune toxicité maternelle ou fœtale n’est observée à la plus faible dose.
Chez les rats exposés 1100 mg/kg pc/j, les mères présentent une diminution du gain de poids et une augmentation du poids du foie ; par portée, les pourcentages de fœtus avec des variations ou des malformations sont augmentés. A la plus forte dose, le gain de poids des mères est considérablement réduit (93 %) ; le pourcentage de résorptions fœtales atteint alors 40 %, 53 % des fœtus sont malformés et leur poids corporel est réduit de 20 %. A partir de ces données, une NOAEL maternelle et développementale de 420 mg/kg pc/j peut être établie pour le rat.
Chez les souris exposées à 910 mg/kg pc/j, seule une diminution du gain de poids est observée chez les mères (17 %) ; à cette même dose, 15 % des fœtus sont non viables et 14 % présentent des malformations. Ces pourcentages atteignent respectivement 93 et 89 %, chez les fœtus des souris exposées à 2330 mg/kg pc/j, leur poids moyen étant diminué de 17 % (chez les mères, baisse de 71 % du gain de poids et augmentation du poids du foie et des reins). A la plus forte dose testée, la mortalité prénatale est totale. A partir de ces données, une NOAEL maternelle et développementale de 182 mg/kg pc/j peut être déterminée pour la souris.
Ema et al. ont étudié la mortalité prénatale et la tératogénicité du BBP chez le rat dans de nombreuses études. A la suite d’une exposition à 0 – 185 – 375 – 654 ou 974 mg/kg pc/j de BBP dans la nourriture, du 1er au 20ème jour de gestation, aucun effet toxique chez les mères n’est rapporté à 185 et 375 mg/kg pc/j ; à partir de 654 mg/kg pc/j, la prise de nourriture et le gain de poids diminuent chez les mères. Une résorption complète de tous les embryons implantés est observée chez les mères exposées à la plus forte dose. Chez les animaux exposés à 375 mg/kg pc/j, le nombre de fœtus vivants par portée diminue mais uniquement pour cette dose ; le poids des fœtus diminue à 654 mg/kg pc/j, en lien avec la baisse de poids des mères. Aux doses testées, le BBP n’est à l’origine ni d’anomalies externes, squelettiques ou internes, ni de variations squelettiques, ni de retard d’ossification [34]. Pour déterminer l’origine de l’embryolétalité à la plus forte dose (embryotoxicité liée à la baisse de la consommation de nourriture des mères ou à la toxicité du BBP), les auteurs ont donné à des rates la même quantité de nourriture que celle prise par les animaux exposés à 974 mg/kg pc/j, du 1er au 20ème jour de gestation, mais sans BBP. Une perte de poids similaire est observée entre les animaux exposés et non exposés au BBP. Par contre, la résorption complète des embryons implantés n’est pas retrouvée chez les rates non exposées : les auteurs en concluent que l’embryolétalité est bien liée au BBP [35].
Des rates ont ensuite été exposées par gavage à 0 – 500 – 750 ou 1000 mg/kg pc/j de BBP, du 7ème au 15ème jour de gestation. A 500 mg/kg pc/j, aucun effet n’est rapporté chez les fœtus et seule la consommation de nourriture diminue chez les mères. A 750 mg/kg pc/j, le gain de poids et la consommation de nourriture des mères sont diminués ; chez les fœtus, sont rapportées une diminution du poids corporel, une hausse des résorptions et une augmentation du nombre de malformations (fente palatine, fusion des sternèbres, dilatation pelvienne). A la plus forte dose, la mortalité maternelle est importante et, chez les femelles encore en vie, on observe une résorption complète des embryons [36].
Plusieurs expériences ont alors été réalisées au cours desquelles des rates gestantes ont été exposées à 974 mg/kg pc/j de BBP, durant différentes périodes de la gestation : GD0-20, GD0-11, GD11-20, GD0-7, GD7-16 ou GD16-20. Les résultats obtenus montrent qu’une exposition lors de la 1ère moitié de la gestation est à l’origine de l’embryolétalité, alors qu’une exposition au cours de la 2nde moitié entraîne des malformations chez les fœtus (fentes palatines et fusion des sternèbres) [36, 37]3. L’origine des pertes post-implantatoires, observées à la suite d’une exposition au début de la gestation, pourrait être liée à une atteinte des fonctions ovariennes, entraînant une diminution des taux de progestérone plasmatique (hormone nécessaire à la gestation) [39, 40].3https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_317§ion=pathologieToxicologie#
L’incidence des malformations externes est plus forte chez la souris. A la suite d’une unique exposition à 280 – 560 – 1120 ou 1169 mg/kg de BBP, le 8ème jour de gestation, sont observés à partir de 560 mg/kg des exencéphalies, la présence d’anus non perforé, des méningocèles, des spina bifida ou des omphalocèles. Chez les mères, une diminution du gain de poids corporel est mesurée aux 2 plus fortes doses et 3 femelles sur 15 meurent à la plus forte dose [41].
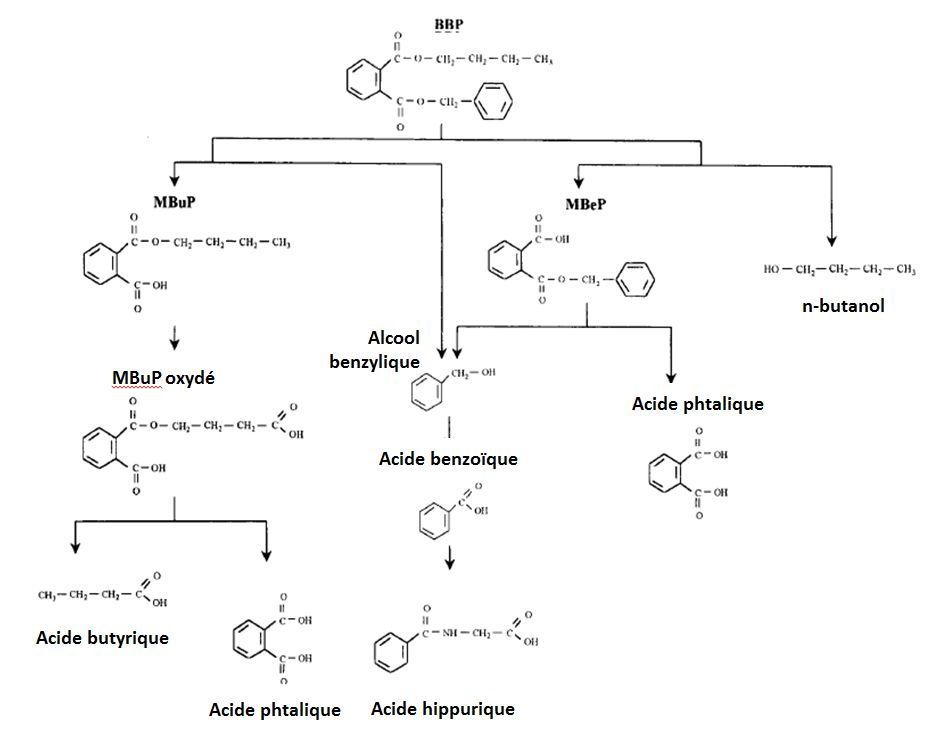
L’exposition au MBuP et au MBeP (métabolites du BBP) est aussi à l’origine de pertes post-implantatoires, de diminution du poids fœtal, de malformations chez les fœtus et de cryptorchidie chez le rat adulte, suggérant que le MBuP et le MBeP sont responsables, au moins en partie, de la toxicité du BBP [41, 42].
Effets pertubateurs endocriniens
L'observation dans la descendance mâle d'une diminution de la distance ano-génitale, d'hypospadias, d’une non régression des mamelons ainsi que d'un retard dans la descente des testicules et la séparation du prépuce indique un vraisemblable effet perturbateur endocrinien de type anti-androgène.
Des rates ont été exposées par gavage à 250 – 500 ou 1000 mg/kg pc/j, du 15ème au 17ème jour de gestation. Pour les 2 plus fortes doses, le nombre de fœtus mâles avec des testicules non descendus augmente et la distance ano-génitale est diminuée (uniquement chez les mâles) [43].
L’évaluation des effets liés à une exposition périnatale a été réalisée par l’exposition de rats à 750 mg/kg pc/j, du 14ème jour de gestation au 3ème jour après la naissance (période critique pour la différentiation sexuelle). Les nouveau-nés mâles présentent une distance ano-génitale réduite, une diminution du poids des testicules, une non régression des mamelons et/ou des aréoles (13ème jour), des malformations de l’appareil reproducteur (à 3-4 mois, hypospadias, cryptorchidie…) [44].
Plusieurs études multi-générations ont été menées au cours desquelles une diminution du poids des fœtus, des effets anti-androgéniques et une toxicité testiculaire ont été observés, le plus souvent en l’absence de toxicité maternelle. Dans l’étude de Nagao et al. [30], les rats ont été exposés à 0 – 20 – 100 ou 500 mg/kg pc/j, dans la nourriture. A partir de 100 mg/kg pc/j, les nouveau-nés des deux sexes présentent une diminution du poids moyen. A la plus forte dose, les effets suivants sont rapportés chez les nouveau-nés : diminution de la concentration en testostérone plasmatique (F0 et F1), diminution de la distance ano-génitale chez les mâles et augmentation chez les femelles (F1), séparation du prépuce retardée (F1), changements macro- et microscopiques au niveau des testicules (à la puberté de F1). Chez les mères, seule une augmentation du poids des reins est rapportée à 100 mg/kg pc/j.
Dans l’étude multi-générations de Tyl et al. [28], les rats ont été exposés à 0 – 50 – 250 ou 750 mg/kg pc/j dans la nourriture. Une diminution de la distance ano-génitale est observée chez les nouveau-nés mâles F1 et F2 dès 250 mg/kg pc/j, en l’absence de toxicité maternelle. A 750 mg/kg pc/j, les nouveau-nés présentent des malformations des organes reproducteurs mâles (F1 et F2), une non régression des mamelons et/ou aréoles (F1 et F2), un retard de puberté (F1, 2 sexes) et une baisse du poids moyen (F1 et F2). A cette même dose, le poids corporel des mères diminue et le poids du foie et des reins augmente. Les mêmes effets sont rapportés dans l’étude multi-générations d’Aso et al. [29] à partir de 200 mg/kg pc/j (gavage).