Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [1]
L’aniline pénètre dans l’organisme par toutes les voies d’exposition ; elle se distribue largement dans les tissus et est métabolisée dans le foie et éliminée majoritairement dans les urines sous forme de métabolites ou sous forme libre.
Chez l'animal
Absorption
L'aniline est un composé liposoluble qui est facilement absorbé par inhalation, par ingestion et à travers la peau. Le taux d'absorption par voie orale est de 89 - 96 % de la dose chez le rat et de 72 % chez la souris.
Distribution
Après absorption, l'aniline se distribue dans tout l'organisme ; chez le rat, la plus forte concentration est retrouvée dans les globules rouges puis le plasma, la rate, les reins, le foie, les poumons, le cœur, le cerveau et le tissu adipeux [12]. Le pic plasmatique apparaît, chez le rat, 0,5, 1 ou 2 heures après l’administration d’une dose unique de 10, 30 ou 100 mg/kg d’aniline respectivement [12]. Après 24 heures, la concentration d'aniline diminue à moins de 2 % de la valeur du pic dans le plasma mais demeure élevée dans les organes (reins > foie > poumons, cœur, rate, cerveau). Après 48 heures, il reste dans les tissus moins de 0,1 % de la dose administrée.
Chez le rat, l’administration répétée par voie orale de 14C-aniline pendant 10 jours induit une accumulation des molécules radiomarquées fixées de façon covalente dans les globules rouges et la rate [12]. La fixation de l'aniline aux macromolécules, notamment pour former des adduits avec l'hémoglobine, est plus faible chez la souris que chez le rat.
L’aniline traverse la barrière placentaire facilement [13].
Métabolisme
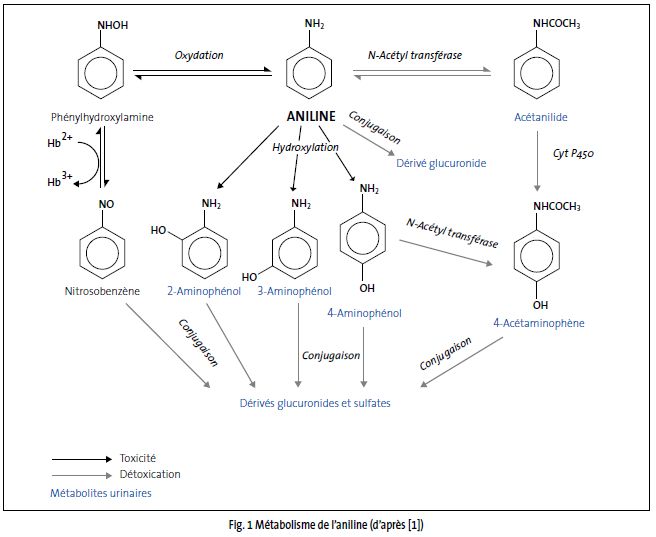
L'aniline est métabolisée dans le foie selon la figure 1.
Schéma métabolique
Excrétion
Dans l'organisme, trois voies métaboliques existent et aboutissent à la formation de conjugués, éliminés majoritairement dans les urines :
- une N-hydroxylation (voie de bioactivation) qui donne naissance à de la phénylhydroxylamine dont une partie se transforme en nitrosobenzène (réaction réversible). Ces deux métabolites ont été mis en évidence dans le sang de rats traités, mais pas dans leurs urines ;
- une N-acétylation via la N-acétyltransférase (voie de détoxication) qui engendre la formation d’acétanilide et de 4-acétaminophène ;
- une hydroxylation du noyau aromatique qui aboutit à la formation de 2-, 3- et 4-aminophénol. Le pourcentage relatif de ces isomères et de leurs dérivés conjugués varie selon l'espèce animale considérée.
Les animaux excrètent, en 3 jours, entre 70 et 89 % de la dose orale dans les urines, en majorité sous forme de dérivés N-acétylés de l'aniline.
Chez le rat, le métabolite majeur à faible dose (< 50 mg/kg par voie orale) est l'acétaminophène sulfo-conjugué ; au-delà de cette dose, une saturation de la voie métabolique (via la N-acétyltransférase) est observée, conduisant à l'élimination de 4-aminophényl-sulfate et de N-acétyl-4-aminophénylglucuronide. Chez la souris, les dérivés glucurono-conjugués représentent la majorité des métabolites excrétés ; il n'y a pas de saturation de cette voie métabolique.
Le rapport des 4-aminophénol et 2-aminophénol éliminés dans l'urine est variable selon les espèces : il est égal à 11 chez le cobaye, 6 chez le lapin et le rat mâle, 2,5 chez le rat femelle, 1,6 chez la souris et 0,5 chez le chat et le chien.
Surveillance Biologique de l'exposition
L’absorption cutanée de l’aniline pouvant être significative, la surveillance biologique est particulièrement intéressante pour apprécier l'intensité de l'exposition.
Le dosage de l'aniline (avec hydrolyse acide) dans les urines en fin d’exposition ou fin de poste est à privilégier pour la surveillance biologique des travailleurs exposés.
Les valeurs biologiques d’interprétation (VBI) professionnelles proposées sont basées sur la relation avec la méthémoglobinémie (méthémoglobinémie attendue inférieure à 5 %, considérée comme ne présentant pas de risque pour la santé). Une VBI issue de la population générale, basée sur le 95ème percentile des valeurs chez des sujets non-fumeurs, est également disponible.
Le taux de méthémoglobine est un indicateur d'effet biologique ayant été proposé pour la surveillance biologique de l’exposition à des agents méthémoglobinisants. C’est un indicateur non spécifique et non quantitatif. Il a également l’inconvénient de nécessiter un prélèvent immédiatement en fin de poste et une analyse dans l'heure suivant le prélèvement en raison de son instabilité. Une méthémoglobinémie supérieure à 1,5 % suggère une exposition à un agent méthémoglobinisant. Des VBI professionnelle et issue de la population générale sont disponibles pour cet indicateur.
-
Mode d'actions
-
Toxicité expérimentale
-
Toxicité sur l’Homme
