Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [3]
Le B[a]P est absorbé par voie orale, pulmonaire et cutanée. Il est distribué largement dans l'organisme et métabolisé en de nombreux métabolites. L'excrétion se fait majoritairement par voie biliaire et plus faiblement urinaire.
Chez l'animal
Absorption
L’absorption du benzo[a]pyrène par voie orale est incomplète et est majorée en présence de graisses dans le tractus gastro-intestinal. Elle a été estimée à environ 40 % chez le rat (1 seule dose, 3-4 nmol), avec un effet de premier passage hépatique important [15]1. Il apparaît dans les canaux lymphatiques thoraciques 3 à 4 heures après administration par sonde gastrique. 1https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
L’absorption à travers l’épithélium pulmonaire est rapide. Immédiatement après inhalation d’un aérosol de 3H-B[a]P (rat, 500 µg/l, 1 h, diamètre aérodynamique moyen 1-2 µm), des quantités significatives de molécules radiomarquées se retrouvent dans le tractus respiratoire supérieur et dans différents organes.
La pénétration cutanée, estimée à partir d’un modèle in vitro de peau animale, est de 10 % de la dose appliquée chez la souris, 1 à 3 % chez le lapin, le rat et 0,1 % chez le cobaye, 24 heures après l’application de 2,5 µg/cm2 de B[a]P radiomarqué sur des explants de peau [16]2. 2https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
In vivo, l’absorption cutanée dans l’acétone est de 51 % chez le singe rhésus (application de 10 ppm pendant 24 h).
Le B[a]P est absorbé par voie orale, pulmonaire ou cutanée. Après absorption, il est rapidement et largement distribué.
Il apparaît dans les canaux lymphatiques thoraciques 3 à 4 heures après administration intragastrique. L’absorption du B[a]P sur la muqueuse intestinale semble précéder une diffusion passive à travers la paroi.
L’absorption à travers l’épithélium pulmonaire est rapide. Immédiatement après inhalation d’un aérosol de 3H]-B[a]P (rat, 500 µg/l, 1 h, diamètre aérodynamique moyen 1-2 pm), des quantités significatives de molécules radiomarquées sont retrouvées dans le tractus respiratoire supérieur, les ganglions lymphatiques thoraciques, les reins et le foie ; les concentrations dans le cerveau, les testicules et la rate sont plus faibles. La clairance pulmonaire est biphasique avec des demi-vies de 2 h et 25-56 h ; cette dernière est probablement due à la métabolisation du B[a]P et à la fixation des métabolites aux macromolécules. La majeure partie de la radioactivité est éliminée du foie et des reins en 24 h, mais elle reste constante dans le cerveau, la rate et les testicules. Le pic d’accumulation dans les intestins atteint son maximum entre 3 et 6 h après l’exposition et diminue rapidement [19].
La pénétration cutanée, in vitro, est de 10 % de la dose appliquée chez la souris, 1 à 3 % chez l’homme, le lapin, le rat et 0,1 % chez le cobaye ; elle augmente si le B[a]P est en solution dans l’acétone (95 % chez le rat, 43 % chez l’homme après 48 h) [20]. In vivo, l’absorption cutanée dans l’acétone est de 51 % chez le singe rhésus et 35-48 % chez le rat. Le B[a]P est métabolisé au niveau cutané. Après absorption cutanée de [14C]-B[a]P, on observe chez la souris une baisse biphasique de la radioactivité sanguine avec des demi-vies de 40 h et 104 h, toute la radioactivité étant éliminée dans les fèces en 16 jours.
Le B[a]P est stocké dans les tissus adipeux et mammaires.
Distribution
Immédiatement après inhalation d’un aérosol de 3H-B[a]P (rat, 500 µg/l, 1 h, diamètre aérodynamique moyen 1-2 µm), des quantités significatives de molécules radiomarquées sont retrouvées dans le tractus respiratoire supérieur, les ganglions lymphatiques thoraciques, les reins et le foie ; les concentrations dans le cerveau, les testicules et la rate sont plus faibles. La clairance pulmonaire est biphasique avec des demi-vies de 2 h et de 25-56 h ; cette dernière est probablement due à la métabolisation du B[a]P et à la fixation des métabolites aux macromolécules. La majeure partie de la radioactivité est éliminée du foie et des reins en 24 h, alors qu’elle reste stable dans le cerveau, la rate et les testicules pendant cette même période [17]3.3https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
Après une absorption par voie orale (rat, 100 mg/kg pc), une forte concentration de B[a]P est mesurée au niveau du foie, 24 heures après l’exposition [18]4.4https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
Le passage transplacentaire a été montré chez des rates gravides exposées par inhalation, des métabolites étant présents chez les petits jusqu’à 15 jours après l’exposition [19]. Chez le rat et la souris, les concentrations mesurées dans l’embryon sont deux fois moins élevées que celles mesurées chez la mère [3]5.5https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
Métabolisme
Le métabolisme du B[a]P du rat est proche de celui de l’Homme. Les enzymes à cytochrome P450 des rongeurs diffèrent légèrement de celles humaines, avec uniquement des CYP1A1 présents chez le rat et la souris. Elles sont présentes dans tous les tissus des mammifères, y compris la peau avec, chez l’animal, le taux le plus élevé dans le foie.
Les adduits à l’ADN sont identiques chez l’Homme et l’animal [3]6. Comme chez l’Homme, le BaP-7,8-dihydrodiol-9,10-époxyde est le métabolite le plus réactif ; il se fixe par liaison covalente aux macromolécules (désoxyguanosine de l’ADN, acides diaminés de l’hémoglobine ou de l’albumine) pour former des adduits. La quantité d’adduits formés in vitro est la plus élevée chez l’homme puis, par ordre décroissant, chez le hamster, le rat et la souris [20]6. Chez le rat, après administration intrapéritonéale, la quantité la plus importante d’adduits à l’ADN se trouve dans les poumons ; elle est en corrélation avec la quantité d’adduits dans les leucocytes. 6https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
Schéma métabolique
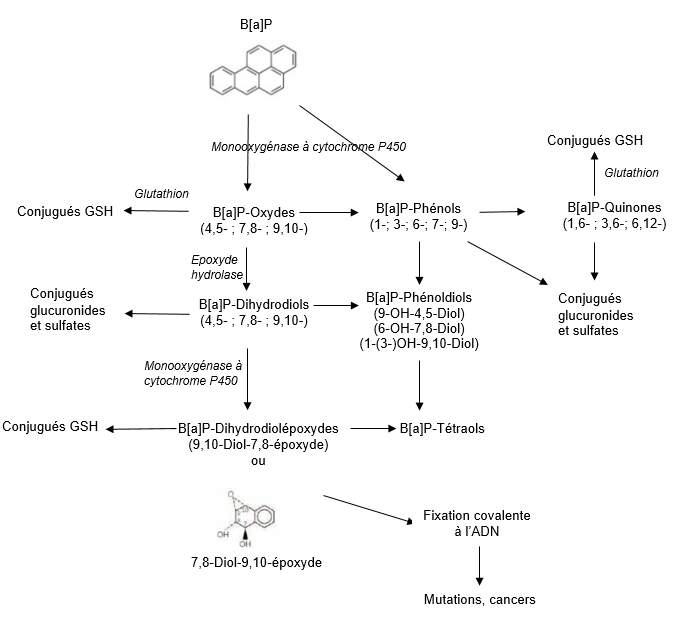
Excrétion
Le système hépatobiliaire et le tractus gastro-intestinal sont les voies principales d’élimination du B[a]P et de ses métabolites, quelle que soit la voie d’exposition. La forte excrétion fécale (70-75 % d’une dose sous-cutanée chez la souris) suggère l’existence d’un cycle entérohépatique.
L’excrétion urinaire est une voie mineure. Chez le rat et la souris, le maximum d’élimination se situe entre 24 et 48 h, la majeure partie de la dose urinaire totale étant excrétée en 72 h. Elle contient des métabolites du B[a]P conjugués sous forme de glucuronides, de sulfates et d’acides mercapturiques (> 80 % de la dose excrétée), des composés phénoliques et des esters, éthers et conjugués avec des sucres neutres (13-18 % de la dose excrétée) [21].
Après absorption cutanée de 14C-B[a]P, on observe chez la souris une baisse biphasique de la radioactivité sanguine avec des demi-vies de 40 h et 104 h, toute la radioactivité étant éliminée dans les fèces en 16 jours.
Il n’y a pas d’élimination dans l’air expiré.
Chez l'Homme
-
Absorption
Très peu de données sont disponibles chez l’Homme. Des études chez les salariés ont montré son absorption après une exposition par inhalation mais sans la quantifier. L’absorption serait rapide, dépendante de la taille des particules sur lesquelles le B[a]P est adsorbé.
Par voie orale, l’absorption est faible (non quantifiée) : elle dépend du véhicule dans lequel il est présent (présence de corps gras), du niveau d’acidité et de la présence d’aliments dans le tractus digestif [22]7.7https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
Aucune donnée n’est disponible concernant le passage percutané du B[a]P in vivo. Cependant, il a pu être estimé à partir de données in vitro : 3 % après 24 heures sur de la peau humaine (dose récupérée dans le compartiment récepteur, après application de 2,5 µg/cm2 de B[a]P radiomarqué dans l’acétone), de 24 à 48 % après 48 heures (dose récupérée dans le compartiment récepteur + la peau, après application de 8 à 10 µg/cm2 dans l’acétone, biopsies réalisées sur des personnes plus ou moins âgées) [16, 23]8.8https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
-
Distribution
Le B[a]P est rapidement distribué dans l’organisme et, du fait de sa forte liposolubilité, il s’accumule dans les glandes mammaires et les autres tissus riches en graisses. Il a été détecté dans le lait maternel, le placenta et le cordon ombilical [24]9.9https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
-
Métabolisme (Cf schéma métabolique)
Le B[a]P peut être transformé en une vingtaine de métabolites oxydés et en un grand nombre de composés conjugués. Son métabolisme a lieu principalement dans le foie et se déroule en plusieurs phases.
L’oxydation initiale est effectuée par une monooxygénase à cytochrome P450 (CYP) qui entraine la formation de métabolites électrophiles et d’époxydes. Cette superfamille d’enzymes microsomiales est présente dans tous les tissus des mammifères, y compris la peau [25]10. L’époxyde hydrolase, contenue dans la fraction microsomiale de nombreux organes et tissus (foie, testicules, ovaires, poumons, reins, peau, intestins, rate, thymus, cerveau et coeur) hydrolyse les époxydes pour former des dihydrodiols, qui sont oxydés à leur tour par une monooxygénase à cytochrome P450 en dihydrodiol-époxydes.10https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
La seconde phase est une phase de conjugaison qui fait intervenir différentes enzymes capables de conjuguer la majorité des métabolites formés avec le glutathion, l’acide glucuronique ou un groupement sulfate. Cette conjugaison a pour objectif d’augmenter la solubilité des métabolites dans l’eau et ainsi de faciliter leur élimination via les urines et les fèces [26, 27]11.11https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
Les enzymes humaines à cytochrome P450 diffèrent de celles des rongeurs [20]12. Cependant, les métabolites formés dans les cellules ou les explants tissulaires humains sont identiques à ceux formés chez l’animal [28]12. Ces enzymes sont inductibles par les HAP.12https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
Le métabolite le plus réactif formé est le BaP-7,8-dihydrodiol-9,10-époxyde (BPDE) qui se fixe de façon covalente aux macromolécules (désoxyguanosine de l’ADN, acides diaminés de l’hémoglobine ou de l’albumine) pour former des adduits. La quantité d’adduits formés in vitro est plus élevée chez l’homme que chez les rongeurs [20]13. Les adduits à l’ADN sont encore détectables 56 jours après la fin de l’exposition ; leur quantité varie selon les individus, en fonction des habitudes alimentaires, des habitudes tabagiques et du polymorphisme génétique [29]13. 13https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
Le benzo[a]pyrène est inducteur de son propre métabolisme en jouant le rôle tant d’inducteur que de substrat des enzymes prenant en charge sa propre biotransformation [3]14. Le passage des hydrocarbures aromatiques polycycliques dans le cytoplasme entraîne une induction spécifique de certaines enzymes métabolisant les xénobiotiques. En effet, un récepteur cytoplasmique très spécifique des HAP, « l’aryl hydrocarbon receptor » (AhR) est lié à diverses protéines cytoplasmiques telles que les « Heat shock protein 90 » (Hsp90) et les « AhR interacting protein » (AIP). L’association entre l’AhR, Hsp90 et l’AIP confère au récepteur cytoplasmique une stabilité dans le cytoplasme assurant la reconnaissance spécifique et optimale vis-à-vis de certains ligands et notamment les HAP dont le benzo[a]pyrène. Il est maintenant établi que la liaison du benzo[a]pyrène au récepteur AhR est déterminante dans l’activation de la transcription des gènes codant pour les enzymes de phase I et de phase II [28]14. 14https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
-
Elimination
Le benzo[a]pyrène et ses métabolites sont principalement éliminés dans les fèces (70 à 75 %). Seuls 4 à 12 % sont éliminés par voie urinaire où l’élimination se fait à 80 % sous la forme de métabolites (métabolites polaires et dérivés phénoliques) et très faiblement sous la forme de benzo[a]pyrène non métabolisé.
Surveillance Biologique de l'exposition
Le dosage du 3-hydroxybenzo[a]pyrène urinaire (3-OHBaP), métabolite du B[a]P, est proposé pour la surveillance biologique des travailleurs exposés à des mélanges d'HAP contenant du B[a]P.
Compte tenu du décalage moyen de 16 heures entre la fin d'exposition et le maximum d'excrétion du 3-OHBaP, le prélèvement doit être réalisé au début du poste suivant (pour évaluer l’exposition de la journée précédente) ou au début de poste en fin de semaine (pour prendre en compte l’accumulation au cours de la semaine de travail). Un prélèvement au début de poste en début de semaine peut être utile pour estimer le niveau de base, après 48 heures sans exposition professionnelle.
Des valeurs biologiques d’interprétation professionnelles et issues de la population générale sont disponibles pour cet indicateur [30]15.15https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_144§ion=pathologieToxicologie#ancre_BiblioTexte
Le tabagisme et l’alimentation (consommation d’aliments grillés au barbecue ou fumés) notamment sont à prendre en compte dans l’interprétation des résultats.
-
-
Toxicité expérimentale
-
Toxicité sur l’Homme
